MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
19.12.2018
Schutz vor Verklumpung: was Proteine aktiv hält
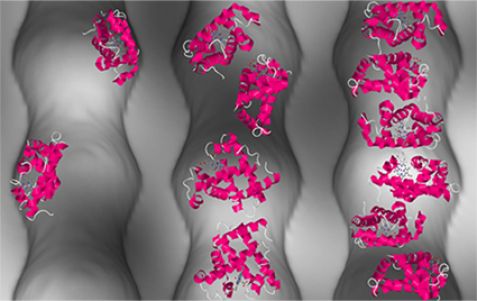
Die Grafik veranschaulicht die Anordnung von Proteinen (rosafarbig) in Nano-Poren bei unterschiedlichen Konzentrationen. © Forschungszentrum Jülich
Neutronenkleinwinkelstreuung an KWS-1 ermöglichte Wissenschaftlern des Forschungszentrums Jülich und des University College London einen Blick in Nanohohlräume, in denen sie die Anordnung von Proteinen untersuchten. Dabei zeigten sie erstmals, dass die Eiweißmoleküle trotz räumlicher Enge nicht verklumpen und lieferten die Erklärung dafür gleich mit.
Eiweißmoleküle sind die Alleskönner der Natur und erledigen ihre spezifischen Aufgaben hocheffizient. Einige wandeln zum Beispiel Stoffe um, andere bekämpfen Krankheitserreger. Die biologischen Maschinen sind deshalb auch wichtig für technische und medizinische Anwendungen. Jedoch klumpen Proteine in hoher Konzentration gerne unwiederbringlich zusammen und verlieren dadurch ihre Wirkung.
Dies ist aber nur außerhalb ihrer natürlichen Umgebung im Inneren von Zellen der Fall. Räumliche Enge kann die Aktivität konzentrierter Proteinlösungen aufrechterhalten. Warum das so ist, war bislang nicht klar. Wissenschaftler des Forschungszentrums Jülich und des University College London zeigen nun erstmals, dass Proteine trotz hoher Konzentration in Nano-Hohlräumen von porösem Siliziumdioxid nicht verklumpen, sondern sich ähnlich einer Flüssigkeit verhalten. Entscheidend für dieses Verhalten sind einerseits die Wechselwirkung zwischen Proteinen und der Oberfläche und andererseits die Krümmung der Nano-Poren, fanden die Wissenschaftler heraus.
Neutronenkleinwinkelstreuung am Instrument KWS-1 mit Dr. Artem Feoktystov am Heinz Maier-Leibnitz Zentrum ermöglichte den Forschern, durch die nanostrukturierten Materialien hindurch die Anordnung der getesteten Proteine Myoglobin und Lysozym direkt zu erkennen. Die Forscher zeigten damit, dass das Verfahren es ermöglicht, Zusammenhänge zwischen der Porenbeschaffenheit, der Anordnung der Proteine und ihrer Aktivität aufzudecken. Das gewonnene Wissen kann für die Entwicklung neuer und verbesserter, bioinspirierter Anwendungen in Biotechnologie, Medizin und Katalyse genutzt werden.
Text: A. Wenzik / Forschungszentrum Jülich
Originalpublikation:
Confinement Facilitated Protein Stabilization As Investigated by Small-Angle Neutron Scattering; Justin Siefker, Ralf Biehl, Margarita Kruteva, Artem Feoktystov, Marc-Olivier Coppens; J. Am. Chem. Soc. 2018, 140, 40, 12720-12723, DOI: 10.1021/jacs.8b08454
Weitere Informationen:
Proteins aggregate not, von Alberto Moscatelli, erschienen in Nature Nanotechnology Volume 13, Page 978 (2018)
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:


