MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
28.02.2019
Neutronen beleuchten Mechanismus einer bislang unheilbaren Erbkrankheit

Am Instrument BioDiff hat Instrumentwissenschaftler Dr. Andreas Ostermann (oben) die Untersuchungen an der stabilen T119M-Mutante durchgeführt. Hier ist er zusammen mit Instrumentwissenschaftler Dr. Tobias Schrader zu sehen. © W. Schürmann / TUM
Wissenschaftler der Keele Universität in Großbritannien und des Insitut Laue-Langevin (ILL) in Frankreich, untersuchten die Ursache für die seltene und unheilbare Transthyretin-Amyloidose. Dabei nutzten sie unter anderem die Methode der Neutronenkristallografie bei Dr. Andreas Ostermann am MLZ-Instrument BioDiff und am ILL Instrument LADI-III, betreut von Dr. Matthew Blakeley um die Details der molekularen Struktur und Interaktionen mit möglichen Medikamenten gegen diese Erbkrankheit aufzuklären.
Transthyretrin-Amyloidose ist eine seltene Krankheit, die oft einen schweren Verlauf nimmt. Ausgelöst wird sie durch eine Fehlfaltung des Transthyretin (TRR), einem Transporteiweiß, das das Schilddrüsenhormon im Blut transportiert und in der Leber produziert wird. Bei der überwiegend vererbten Krankheit kann ein Defekt im entsprechenden Gen (Mutation) zu einer Fehlfaltung des Eiweißes führen. Das Protein wird schnell instabil und lagert sich als abnorm gefaltetes Eiweiß, als sogenanntes Amyloid, im Gewebe und in Organen ab, was bis zum Organversagen führen kann.
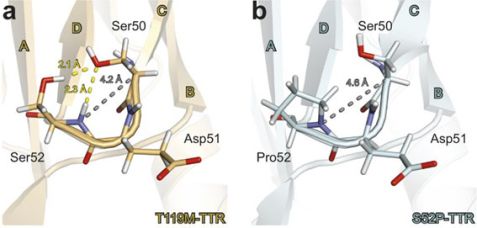
a und b: Die CD-Schleife in Transthyretin ist in der S52P-Mutante im Vergleich zur T119M-Mutante und der nativen Form destabilisiert. Die Stabilität der CD-Schleife an der Mutationsstelle S52P wird in Verbindung mit dem aggressivsten Krankheitsverlauf gebracht wird. Die Mutation an der Stelle S52P begünstigt eine Entfaltung des Proteins, die zu schädlichen amyloiden Ablagerungen führt.
Die Forscher verglichen die Strukturen und Stabilitäten des gesunden TRR mit zwei mutierten TRR-Formen T119M und S52P, mit Hilfe von Massenspektrometrie, Computersimulationen, Röntgenstrahlen und Neutronenkristallografie. Ziel war es herauszufinden, wie und warum sich die amyloiden Fibrillen bilden. S52P löst eine sehr aggressive Form der Erkrankung aus, während T119M sogar schützenden Einfluss ausübt. Beim Vergleich ihrer molekularen Strukturen erhielten die Wissenschaftler Auskunft über die Mechanismen, die bei der Entstehung der Krankheit am Werk sind.
Das monochromatische Einkristalldiffraktometer BioDiff am MLZ ist ein gemeinsames Instrument der Technischen Universität München und des Forschungszentrums Jülich und speziell dafür ausgelegt, die Struktur von biologischen Makromolekülen zu bestimmen. Hier untersuchte Dr. Ai Woon Yee von der Keele Universität zusammen mit dem Instrumentwissenschaftler Dr. Andreas Ostermann die Struktur der sehr stabilen T119M-Mutante. Leichte Atome, wie Wasserstoff, die in diesem großen biologischen Molekül eingebaut sind und eine wichtige Rolle spielen, waren klar sichtbar. Über die Lokalisierung der Wasserstoffatome konnten die Wissenschaftler die Wasserstoffbrückenbindungen in dem Molekül erkennen, vor allem in einem Bereich, der CD-Schleife genannt wird, und sehr anfällig für die Entfaltung des Eiweißes ist.
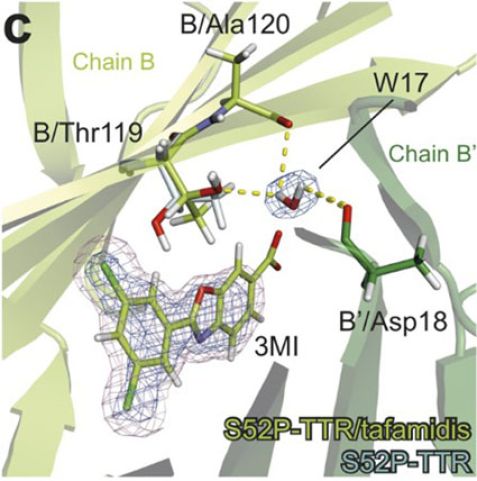
c: Die Bindung des Medikaments Tafamidis an das Molekül Transthyretin. Die Struktur zeigt wie die Bindung des Medikaments die Struktur der schützenden T119M-Mutation nachahmt.
Transthyretin besteht aus vier Untereinheiten, sogenannten Monomeren, die hierarchisch aufeinander aufbauen. Die Messergebnisse für T119M zeigten, dass diese Mutation die Stabilität der Dimer-Dimer-Schnittstelle und damit der tetrameren Gesamtstruktur erhöht. Im Gegensatz dazu scheint die S52P-Form eine lockerere und damit destabilsierte CD-Schleife im Monomer zu besitzen, weil eine wichtige Wasserstoffbrückenbindung nicht zustande kommt. Deshalb sind auch die Dimer- und Tetramer-Struktur instabil. Es wird angenommen, dass das Auseinanderfallen der tetrameren Struktur des TRR-Moleküls den geschwindigkeitsbestimmenden Schritt bei der die Bildung von amyloiden Fibrillen darstellt.
Die unterschiedliche Stabilität der CD-Schleife in der Mutation S52P und der Mutante T119M (sowie der nicht mutierten Form) könnte erklären, warum Patienten mit S52P Mutation zu einer aggressiven Form der Krankheit neigen. Zusätzlich verstärkt die Mutation T119M die Bindung zwischen den Dimeren, was wiederum die gesamte Stabilität der Tetramerstruktur erhöht.
Derzeit gibt es keine Heilung für TRR Amyloidose. Momentan besteht lediglich die drastische Möglichkeit der Lebertransplantation. Verschiedene Medikamente, die verhindern sollen, dass die abnormal gefalteten Proteine gebildet werden, befinden sich derzeit noch in der Testphase. Lediglich ein Medikament – Tafamidis – ist derzeit auf dem Markt, das die Krankheit hinauszögert. Die Wirkung dieses Medikaments auf TRR haben die Wissenschaftler in ihrer Studie ebenfalls untersucht. Ergebnisse zeigen, dass es die Struktur auf ähnliche Weise stabilisiert wie die Mutation T119M. Das Medikament verursacht eine Änderung in dem Molekül, die der Struktur der T119M-Mutation gleicht und stoppt das Auseinanderfallen des Tetramers. Dies könnte helfen, innovative Medikamente herzustellen, und irgendwann eine Heilung dieser Krankheit in Aussicht stellen.
Originalpublikation
AW Yee, M Aldeghi, MP Blakeley, A Ostermann, P Mas, M Moulin, D de Sanctis, MW Bowler, C Mueller-Dieckmann, EP Mitchell, M Haertlein, B de Groot, E Boeri Erba, VT Forsyth, Nature Communications 10:925 (2019). DOI: 10.1038/s41467-019-08609-z
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:


