MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
02.07.2020
Die Entgiftungsreaktion von Vitamin C
Neutronen machen erstmals Reaktionswege wichtiger Enzyme sichtbar

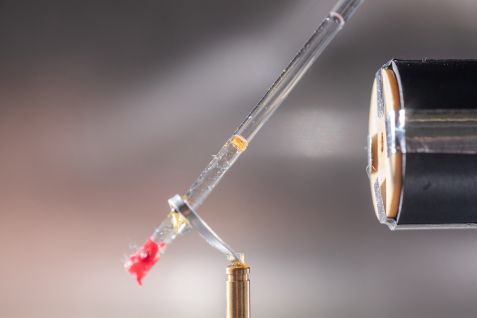
Dr. Andreas Ostermann justiert am BioDiff einen Kristall für die Neutronenmessung. © Andreas Heddergott
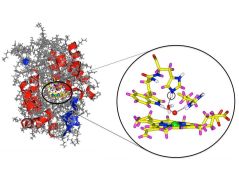
Vitamin C spielt eine lebenswichtige Rolle für Pflanzen und Tiere: Es entgiftet Zellen, indem es hilft, Wasserstoffperoxid abzubauen. Wie diese enzymatische Reaktion abläuft, war bisher jedoch nicht vollständig klar. Mittels Neutronen hat nun ein internationales Forscherteam erstmals Vitamin C dabei detailliert sichtbar gemacht und Reaktionswege vorgeschlagen.
Zitrusfrüchte sind besonders reich an Ascorbinsäure, oft auch Vitamin C genannt. Nicht nur im menschlichen Körper leistet das Vitamin wichtige Dienste. Auch in pflanzlichen Zellen benötigt das Enzym Ascorbat-Peroxidase Vitamin C um das Zellgift Wasserstoffperoxid in Wasser umzuwandeln.
Bei dieser Reaktion müssen Protonen und Elektronen von der Ascorbinsäure mit Hilfe des Enzyms zum Wasserstoffperoxid übergehen. Die Ascorbat-Peroxidase steht dabei beispielhaft für eine ganze Reihe von Enzymen, die auch im menschlichen Körper durch die Übertragung von Protonen und Elektronen bei vielen lebenswichtigen Reaktionen eine entscheidende Rolle spielen.
Neutronen zeigen die Wasserstoffatome
„Mangels geeigneter Messmethoden war bislang unklar, welchen Weg die Protonen genau nehmen und in welchem Zustand das Vitamin C bei der Reaktion vorliegt“, sagt die Leiterin der Studie, Prof. Emma Raven von der Universität Bristol.
Bislang wurden Enzyme hauptsächlich mit Röntgenstrahlen analysiert. Doch sehr leichte Atome, wie beispielsweise Wasserstoff, sind für Röntgenstrahlung nahezu unsichtbar. Neutronen dagegen sind auch für leichte Atome empfindlich. Daher ließ das britische Team die Proben an der Forschungs-Neutronenquelle Heinz Maier-Leibniz (FRM II) der Technischen Universität München (TUM) und dem Institut Laue-Langevin (ILL) in Grenoble (Frankreich) analysieren.
Überraschend: neutral statt positiv
Am Instrument BioDiff können Wissenschaftler die Struktur von biologischen Molekülen mit Hilfe von Neutronen untersuchen. © Andreas Heddergott
Einen Kristall des Enzyms Ascorbat-Peroxidase mit gebundenem Vitamin C brachte das Team zur Forschungs-Neutronenquelle nach Garching, wo ihn Wissenschaftler des Heinz Maier-Leibnitz Zentrums (MLZ) analysierten. Als Referenz-Struktur ließen sie am Institut Laue-Langevin einen Enzym-Kristall ohne gebundenes Vitamin C untersuchen.
Dr. Tobias Schrader (Forschungszentrum Jülich) und Dr. Andreas Ostermann (Technische Universität München) führten die Messung an ihrem Instrument BIODIFF durch. Das aus den Messdaten gewonnene Strukturmodell überraschte
die britischen Biochemiker.
„Ein spezieller Teil des Enzyms, ein Arginin-Aminosäurebaustein, lag neutral vor“, sagt Prof. Peter Moody von der University of Leicester, der die Arbeit zusammen mit Prof. Emma Raven betreute. „Bisher hatte man angenommen, dass er positiv geladen sei.“ Damit fehlt dem Enzym an dieser Stelle ein Proton. Das wiederum deutet darauf hin, dass über diesen Weg ein Proton vom Vitamin C in das aktive Zentrum gewandert sein könnte.
Erkenntnisse übertragbar auch auf andere Enzym-Reaktionen
In der Nähe befindet sich mit einem Histidin-Aminosäurebaustein ein weiterer Kandidat im aktiven Zentrum, der ein Proton aufnehmen oder abgeben kann. Beide zusammen könnten die Grundlage für einen allgemeinen Mechanismus zum Protonentransport bilden.
Einen dritten Weg, um Protonen zum aktiven Zentrum des Enzyms zu befördern, sieht das Wissenschaftsteam in einer Kette von Wassermolekülen. Diese liegen zwar relativ weit auseinander, könnten jedoch durch geringfügige Positionswechsel ebenfalls einen Protonentransport realisieren.
„Mit der Neutronenstreuuntersuchung haben wir drei mögliche Wege identifiziert, auf denen ein für die Reaktion benötigtes Proton in das aktive Zentrum des Enzyms gelangen kann“, sagt Emma Raven. „Die Ascorbat-Peroxidase gehört zur großen Gruppe der Hämenzyme. Mit diesen Ergebnissen können wir auch gleichartige Reaktionen bei anderen Enzymen dieser Familie besser verstehen.“
Originalpublikation:
Visualizing the protons in a metalloenzyme electron proton transfer pathway. Hanna Kwon, Jaswir Basran, Juliette M. Devos, Reynier Suardiaz, Marc W. van der Kamp, Adrian J. Mulholland, Tobias E. Schrader, Andreas Ostermann, Matthew P. Blakeley, Peter C. E. Moody, Emma L. Raven. PNAS, first published March 9, 2020. DOI: 10.1073/pnas.1918936117
Mehr Information:
Die Forschungsarbeiten wurden gefördert durch das Biotechnology and Biological Sciences Research Council und das Engineering and Physical Sciences Research Council im Rahmen des UK Catalysis Hub. Neutronenstrahlung zur Bestimmung der Kristallstrukturen lieferten die Forschungs-Neutronenquelle Heinz Maier-Leibniz (FRM II) in Garching und das Institut Laue-Langevin in Grenoble (Frankreich). Rechenzeit stellten das Advanced Computing Research Centre der University of Bristol und das ARCHER UK National Supercomputing Service zur Verfügung.
Weitere News
-
10.07.2014
Eiskalt erwischt
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien: