MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
12.06.2020
Wasserstoff – aber bitte effizient

Wasserstoff gilt als sauberer Energieträger und wird bereits als Treibstoff eingesetzt. Seine Herstellung benötigt jedoch noch viel Strom. © Adobe Stock
Wasserstoff als Energieträger wird in der Energiewende eine wichtige Rolle spielen. Doch um ihn aus Wasser CO2-neutral durch Elektrolyse herzustellen, benötigt es eine Menge Strom. Neutronen helfen dabei, Materialien zu untersuchen, die den Stromverbrauch bei dieser Reaktion senken können.
Die Elektrolyse von Wasser braucht viel Strom
Elektrischer Strom zerlegt Wasser in seine Bestandteile Wasserstoff und Sauerstoff. Diese sogenannte elektrolytische Spaltung hat jedoch mehrere Nachteile.
Erstens ist der Wirkungsgrad der Reaktion nicht optimal. Katalysatoren senken den Energiebedarf chemischer Reaktionen – die Verwendung von katalytisch aktiven Elektrodenmaterialien sorgt also für mehr Wasserstoff bei gleicher Spannung. Zweitens entsteht bei der Oxidation von Wasser Sauerstoff, der unter diesen Bedingungen gegenüber den Elektroden sehr korrosiv wirkt – das Elektrodenmaterial muss dem standhalten können.
Stannit: Ein vielversprechendes Elektrodenmaterial
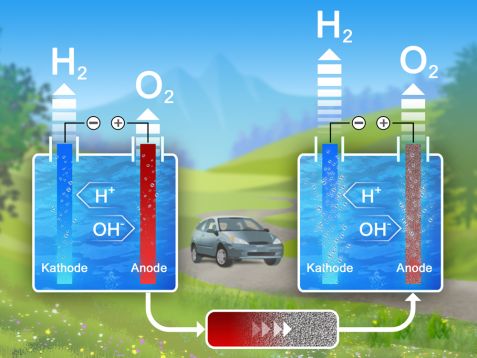
Bei der Elektrolyse spaltet elektrischer Strom das Wasser in seine Bestandteile Wasserstoff und Sauerstoff (links). Katalysatormembranen um die Anode, wie das neu untersuchte Material Stannit, erhöhen den Wirkungsgrad und damit auch die Menge an erzeugtem Wasserstoff (rechts). © Reiner Müller / FRM II, TUM
Neuartige Materialien, die einerseits katalytisch aktiv sind und andererseits dieser korrosiven Umgebung widerstehen können, werden aktuell weltweit erforscht. Wissenschaftler der Technischen Universität Berlin haben das natürlich vorkommende Mineral Stannit (Cu2FeSnS4) synthetisch hergestellt und elektrochemisch als dünne Schicht auf Trägermaterialien wie metallisches Nickel abgeschieden.
Diese Komposition dient als Ausgangsstoff für den eigentlichen Katalysator: Bei der elektrokatalytischen Reaktion lösen sich Zinn (Sn) und Schwefel (S) vollständig heraus, was die gesamte Struktur der Verbindung verändert. Als eigentlicher Katalysator bleibt von dem Stannit nur in einer kupferhaltigen Matrix gebundenes FeOOH übrig.
Dieser Katalysator ist den bisher üblichen Katalysator-Materialien, wie zum Beispiel Edelmetalloxiden und Eisen- bzw. Zinnsulfiden, in seiner Aktivität deutlich überlegen, haben die Forscher festgestellt. Außerdem besteht er, im Gegensatz zu Edelmetallverbindungen, aus ausschließlich reichlich in der Erdkruste vorkommenden Elementen, wie Eisen, Zinn und Schwefel.
Neutronen erlauben den Durchblick
Allerdings kann man katalytische Prozesse nur verstehen und die eingesetzten Materialien weiter verbessern, wenn man Struktur, Bindungsverhältnisse und Veränderungen kennt.
Neutronen am MLZ-Diffraktometer SPODI bewerkstelligten die komplexe Strukturaufklärung von Stannit: Neutronendiffraktion unterscheidet im Vergleich zu anderen Verfahren die in der Elektronenanzahl ähnlichen Elemente Eisen und Kupfer bzw. Zinn und Schwefel voneinander.
„Das Rapid Access Programm, der schnelle Zugang zu dem Instrument und der gemessenen Daten, ist eine Schlüsselkomponente im Erfolg dieser Zusammenarbeit, aber auch des gesamten Programms“, so Dr. Anatoliy Senyshyn, Instrumentverant- wortlicher am SPODI.
Erfolg öffnet Türen für weitere Forschung
Stannit ist die erste Verbindung dieser Substanzklasse, bei der die Eignung als Ausgangsprodukt für katalytisch aktive Elektrodenmaterialien zur Herstellung von Wasserstoff untersucht wurde. Es ermöglicht einen Schritt in Richtung CO2-neutraler und energieeffizienterer Wasserstofftechnologie.
Originalveröffentlichung:
Jan Niklas Hausmann, Eva Maria Heppke, Rodrigo Beltran-Suito, Johannes Schmidt, Martin Mühlbauer, Martin Lerch, Prashanth Wilfried Menezes, Matthias Driess. Stannites – A New Promising Class of Durable Electrocatalysts for Efficient Water Oxidation, ChemCatChem, 12, 1161 (2020). DOI: 10.1002/cctc.201901705
Weitere News
-
04.12.2013
Gruppendynamik von Atomen
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien: