MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
27.10.2021
Was mit mRNA-Medikamenten im Körper passiert
Zum zweiten Mal arbeiteten Forschende des Heinz Maier-Leibnitz-Zentrums (MLZ), des globalen biopharmazeutischen Unternehmens AstraZeneca und der Universität Malmö zusammen, um das Verständnis für mRNA-Therapeutika zu verbessern. Diesmal lag ihr Fokus auf einem bestimmten Eiweiß und der Frage, was genau mit der mRNA passiert, sobald sie ins Blut verabreicht wird.
Die sogenannte messenger-RNA (deutsch „Boten-RNA“) ist der Bauplan für die Herstellung von Proteinen, den eine Zelle lesen und umsetzen kann. Dieses Prinzip wollen sich die Forschenden in Form von mRNA-Therapeutika zunutze machen. Dabei wird den Patientinnen und Patienten mRNA verabreicht, die spezifisch den Bauplan für die benötigten Proteine enthält. Die Anwendungsmöglichkeiten sind vielfältig und reichen von Krebs bis hin zu chronischen Krankheiten wie Herzversagen.
Wissenschaftlerinnen und Wissenschaftler von AstraZeneca haben in Zusammenarbeit mit Dr. Aurel Radulescu, Instrumentwissenschaftler an der Kleinwinkelstreuanlage KWS-2 des Forschungszentrum Jülich, bereits zwei Publikationen zur mRNA-Medikamentenforschung veröffentlicht. Nach der strukturellen Charakterisierung von Lipid-Nanopartikeln (LNPs), die als Verpackung und Transportmittel für mRNA bei der Verabreichung dienen, untersuchten sie in einem zweiten Schritt, wie sich die Verträglichkeit bei subkutaner Anwendung durch die Zugabe von entzündungshemmenden Agentien verbessern lässt. Das eröffnet Patientinnen und Patienten die Möglichkeit, sich ihr Medikament selbst zu verabreichen.
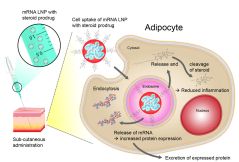
In einem Lipid-Nanopartikel ist die mRNA (grüne Spirale) verpackt. Die einzelnen strukturellen Komponenten des Partikels machten Forschende mithilfe von Neutronen sichtbar © Reiner Müller / ACS Nano 2021, 15, 6709-6722
Test unter realen Bedingungen
Für ihre aktuelle Arbeit holte sich das Forschungsteam unter der Leitung von Dr. Federica Sebastiani vom Department of Biomedical Science der Universität Malmö zusätzliche Unterstützung ins Boot. Zusammen untersuchten sie, wie die mRNA-enthaltenden Lipid-Nanopartikel (mRNA-LNPs) in einem Modellsystem an Proteine im Blut des Patienten binden, an den richtigen Ort transportiert werden und dort die mRNA wieder freigeben. Als Bindepartner im Fokus stand dabei das Apolipoprotein E.
„Das Besondere bei dieser Arbeit ist, dass wir die LNPs nicht mehr in einem idealen System, ohne jegliche Störfaktoren, untersucht haben, sondern in einem echten System“, erklärt Dr. Aurel Radulescu. Die Umgebung ähnelt diesmal mehr der im menschlichen Körper.
Neutronen machen störende Lipide unsichtbar
Um die genaue Struktur der mRNA-LNPs und die Verteilung der einzelnen Komponenten im Komplex zu untersuchen, nutzen die Wissenschaftlerinnen und Wissenschaftler die Kleinwinkelstreuanlage KWS-2. „Für die Strukturanalyse bieten uns die Neutronen eine einzigartige Untersuchungsmethode“, so Radulescu.
Die LNPs bestehen aus drei verschiedenen Fett-Molekülen zu verschiedenen Anteilen. Sie alle haben unterschiedliche Streueigenschaften. Indem die Forschenden die Streuung einzelner Fette durch den Austausch von Wasserstoffatomen mit schwereren Deuterium-Atome gezielt auf Null setzten, machten sie diese unsichtbar. Sie sahen so, wo genau sich die einzelnen Moleküle in der Struktur befanden.
Die Forschenden fanden heraus, dass sich die Struktur der mRNA-LNPs maßgeblich ändert, sobald sie an Apolipoprotein E im Blut binden. Es kommt zur Umverteilung der Lipid-Moleküle an der Oberfläche und im Kern, was wiederum Einfluss auf die Eigenschaften der LNPs hat, beispielsweise wie einfach sie die gebundene mRNA wieder freigeben können.
Genaueres Medikamenten-Design möglich
Die Ergebnisse des Forschungs-Teams haben das Potenzial, die Entwicklung von mRNA-Therapeutika zu optimieren. So ist jetzt bekannt, dass ein Teil der LNPs zunächst in der Leber fest gebunden wird. Wenn man weiß, welcher Anteil der mRNA schlussendlich die Zielzellen der Therapie erreicht, wird das Schicksal der mRNA-LNPs im Körper deutlicher. So haben die Forschenden ein noch besseres Verständnis dafür gewonnen, wie die mRNA-Medikamente wirken.
Originalpublikation:
F. Sebastiani, M. Yanez Arteta, M. Lerche, L. Porcar, C. Lang, R.A. Bragg, C.S. Elmore, V.R. Krishnamurthy, R.A. Russell, T. Darwish, H. Pichler, S. Waldie, M. Moulin, M. Haertlein, V.T. Forsyth, L. Lindfors, M. Cárdenas, Apolipoprotein E binding drives structural and compositional rearrangement of mRNA-containing lipid nanoparticles, ACS Nano 15(4) (2021), DOI: 10.1021/acsnano.0c10064
Weitere News
-
11.03.2021
Neutronen für bessere mRNA-Impfstoffe
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien: