MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
28.12.2021
Optimaler Einbau des mRNA-Wirkstoffs in Nanopartikel
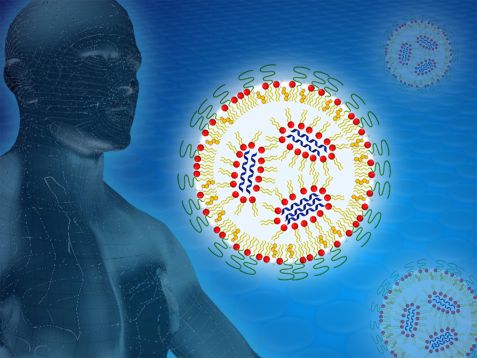
In einem Lipid-Nanopartikel ist die spiralförmige mRNA verpackt. Die einzelnen strukturellen Komponenten des Partikels machten die Forschenden mithilfe von Neutronen am FRM II sichtbar. © BioNTech / Reiner Müller, FRM II/TUM
Die Forschungs-Neutronenquelle Heinz Maier-Leibnitz (FRM II) der Technischen Universität München (TUM) spielt eine wichtige Rolle bei der Untersuchung von mRNA Nanopartikeln, ähnlich zu denen die im Covid-19-Impfstoff der Firmen BioNTech und Pfizer eingesetzt werden. Mit Hilfe des in Garching verfügbaren hohen Neutronenflusses gelang es den Forschenden am Heinz Maier-Leibnitz Zentrum (MLZ), unterschiedliche Formulierungen für den mRNA-Impfstoff zu charakterisieren und damit Grundlagen für die Verbesserung von deren Wirksamkeit zu schaffen.
Messenger-RNA (mRNA, deutsch „Boten-RNA“) als Wirksubstanz zu verwenden ist im Prinzip eine geniale Idee: Das Molekül enthält den spezifischen Bauplan für Proteine, die dann von der Zelle synthetisiert werden. Damit kann grundsätzlich eine sehr große Bandbreite unterschiedlicher therapeutisch wirksamer Proteine bereitgestellt werden.
Im Fall des Covid-19 Impfstoffs sind das die Proteine der charakteristischen Spikes auf der Oberfläche des Corona-Virus, die für die Impfung eingesetzt werden. Diese werden auf der Oberfläche von Immunzellen präsentiert woraufhin das Immunsystem des Menschen die Abwehr gegen diese körperfremden Eiweißstoffe und damit gegen die Corona-Viren einleitet. Die mRNA selbst wird nach wenigen Stunden wieder vollständig abgebaut, was vorteilhaft für die Sicherheit dieser Impfstoffe ist.
Der Weg zur besten Verpackung
Damit die mRNA nicht schon auf dem Weg zur Zelle von den allgegenwärtigen Enzymen des Körpers abgebaut wird, muss man sie entsprechend verpacken. Dies geschieht durch Nanopartikel, die aus einer Mischung aus Lipiden oder Polymeren bestehen können.

Dr. Aurel Radulescu (r.) mit Kollegin am Probenort des Neutronenkleinwinkeldiffraktometers KWS-2 am FRM II in Garching. © Wenzel Schürmann / TU München
Die Lipide sind Fettmoleküle, die den Molekülen der Zellhülle ähneln und dabei helfen, die mRNA ins Zellinnere abzugeben. Lipide und Biopolymere werden danach vom Körper wieder abgebaut oder ausgeschieden.
In Zusammenarbeit mit der Gruppe von Prof. Peter Langguth, Abteilung Pharmazeutische Technologie am Institut für Pharmazeutische und Biomedizinische Wissenschaften der Johannes-Gutenberg Universität Mainz, entwickelte das von Dr. Heinrich Haas geleitete Formulierungsteam der Firma BioNTech zu diesem Zweck eine Reihe von Formulierungen, bei denen die Nanopartikel aus in der Pharmazie bereits bewährten Lipiden und Biopolymeren in unterschiedlichen Mischungen bestanden.
Durchleuchtung mit Neutronen
Um die Eigenschaften verschieden zusammengesetzter Nanopartikel miteinander zu vergleichen, unterzogen die Forschenden sie unterschiedlichsten Untersuchungen. Neben Röntgen- und mikroskopischen Analysen zählte dazu auch die Bestrahlung mit Neutronen am Instrument KWS-2, das das Forschungszentrum Jülich am FRM II der TU München in Garching betreibt.
Die Neutronen werden dabei im Inneren der Nanopartikel unter anderem an den Wasserstoffkernen gestreut und auf charakteristische Weise von ihrem Weg abgelenkt. Daraus lassen sich Rückschlüsse auf deren Verteilung ziehen.
Tauscht man nun die Wasserstoffatome bestimmter Komponenten – zum Beispiel nur der Lipide – gegen schweren Wasserstoff aus, ändern sich zwar nicht die chemischen Eigenschaften oder die pharmazeutische Wirkung, jedoch die Streuung der Neutronen.
„Mit dieser Methode lassen sich Teile einer komplexen Mehrkomponenten-Morphologie selektiv hervorheben, ohne die physikalische Chemie der Probe zu verändern“, sagt Dr. Aurel Radulescu vom Jülich Centre for Neutron Science (JCNS), der für das Instrument KWS-2 verantwortlich ist und die Auswertung der Messergebnisse leitete. „Auf diese Weise können Struktureigenschaften dargestellt werden, die mit anderen Methoden nicht, oder kaum, sichtbar zu machen sind.“
Das rechte Maß an Ordnung macht‘s
Bei diesen Analysen interessierten sich die Forschungsteams dafür, wie effizient die Übertragung der mRNA in die Zelle, die sogenannte Transfektion, bei den unterschiedlichen Formulierungen funktionierte. Auf diese Weise fanden die Forscherinnen und Forscher heraus, dass die höchste Transfektionsrate mit Nanopartikeln erhalten wurde, die sich durch eine bestimmte Art der inneren Ordnung auszeichnen.
„Immer wenn sich geordnete und weniger geordnete Bereiche im Inneren der Nanopartikel in charakteristischer Weise abwechselten wurde eine hohe biologische Aktivität festgestellt. Hierbei könnte es sich um ein allgemeingültiges Konzept der Struktur-Aktivitätsbeziehung handeln, das unabhänging von den hier untersuchten Sytemen anwendbar ist“, hebt Dr. Heinrich Haas von der BioNTech hevor. Eine ähnlich niedrige Ordnung wurde von den Forschungsteams zuvor auch schon mit Hilfe von Röntgenstrahlung in anderen Lipidnanopartikeln gefunden.
Ein verbessertes Verfahren
Um die gewünschten Struktureigenschaften zu erhalten mussten Lipide und Biopolymere mit genau bestimmten Verfahren mit der mRNA zusammengebracht werden. Dabei konnten das Forschungsteam zeigen, dass sich die Nanopartikel zur Verpackung der mRNA in einem Schritt herstellen lassen, was im Vergleich zu einem ursprünglich ebenfalls erprobten Zwei-Schritt-Verfahren eine erhebliche Vereinfachung bedeutet.
So konnte am Ende eine vereinfachte Methode zur Herstellung von mRNA Nanopartikeln mit verbesserter Aktivität gefunden werden. „Solche Fragen der praktischen Herstellbarkeit stellen eine wichtige Voraussetzung für die Entwickelbarkeit pharmazeutischer Produkte dar“, stellt Prof. Langguth klar. In der Zukunft können solche Konzepte in der Entwicklung neuer mRNA basierter Therapeutika mit berücksichtigt werden.
Publikationen:
Hybrid Biopolymer and Lipid Nanoparticles with Improved Transfection Efficacy for mRNA
Christian D. Siewert, Heinrich Haas, Vera Cornet, Sara S. Nogueira, Thomas Nawroth, Lukas Uebbing, Antje Ziller, Jozef Al-Gousous, Aurel Radulescu, Martin A. Schroer, Clement E. Blanchet, Dmitri I. Svergun, Markus P. Radsak, Ugur Sahin and Peter Langguth
Cells 2020, 9(9), 2034 – DOI: 10.3390/cells9092034
Investigation of charge ratio variation in mRNA – DEAE-dextran polyplex delivery systems
C. Siewert, H. Haas, T. Nawroth, A. Ziller, S. S. Nogueira, M. A. Schroer, C. E. Blanchet, D. I. Sverg, A. Radulescu, F. Bates, Y. Huesemann, M. P. Radsak, U. Sahin, P. Langguth
Biomaterials, 2019; DOI: 10.1016/j.biomaterials.2018.10.020
Polysarcosine-Functionalized Lipid Nanoparticles for Therapeutic mRNA Delivery
S S. Nogueira, A. Schlegel, K. Maxeiner, B. Weber, M. Barz, M. A. Schroer, C. E. Blanchet, D. I. Svergun, S. Ramishetti, D. Peer, P. Langguth, U. Sahin, H. Haas
ACS Appl. Nano Mater. 2020, 3, 11, 10634–10645 – DOI: 10.1021/acsanm.0c01834
Mehr Informationen:
Die Arbeiten wurden gefördert durch das Bundesministerium für Bildung und Forschung (BMBF), die Deutsche Forschungsgemeinschaft (DFG) im Rahmen des Sonderforschungsbereichs SFB 1066, das Max Planck Graduate Center (MPGC-Mainz) und den Lewis Trust.
Die Kleinwinkel-Neutronenstreuungs-Experimente (Small Angle Neutron Scattering, SANS) wurden am Instrument KWS-2 an der Forschungs-Neutronenquelle FRM II der Technischen Universität München durchgeführt. Im Rahmen des Heinz Maier-Leibnitz Zentrums wird das Instrument dort vom Jülich Centre for Neutron Science betrieben.
Die Kleinwinkel-Röntgenstreuungs-Experimente (Small Angle X-ray Scattering, SAXS) wurden an der vom Europäischen Laboratorium für Molekularbiologie (EMBL) betriebenen P12-Beamline an der PETRA III Synchrotron-Strahlungsquelle des Deutschen Elektronen Synchrotron (DESY) in Hamburg durchgeführt.
Kontakt:
Dr. Aurel Radulescu
Forschungszentrum Jülich
Jülich Centre for Neutron Science (JCNS-FRM-II)
Lichtenbergstr. 1, 85748 Garching
Tel.: +49 89 289 10712
E-Mail: a.radulescu@fz-juelich.de
Web: https://mlz-garching.de/kws-2/de
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:



