MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
15.07.2016
Neutronen beobachten die Wirkung von Alzheimer-Peptiden
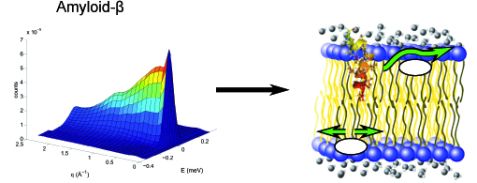
Die Bewegungen der Lipide verändern sich deutlich, wenn das Alzheimer-Peptid Amyloid β anwesend ist. (Links: Beispielhafte Ergebnisse der Messungen mit TOFTOF, rechts: modellhaftes Verhalten der Lipidbewegungen) © M. Barrett (HZB)
Mit Hilfe von Neutronen haben Wissenschaftler jetzt die möglichen Ursachen der Alzheimer Erkrankung untersucht. Bei Messungen, unter anderem am Instrument TOFTOF des Heinz Maier-Leibnitz Zentrum in Garching, beobachteten sie eine veränderte Beweglichkeit der Lipide in der Membran, wenn das Peptid Amyloid-β anwesend ist, das als Auslöser von Alzheimer gilt.
Bei der Alzheimer Erkrankung entstehen außerhalb der Nervenzellen sogenannte Plaques, die überwiegend aus dem Peptid Amyloid-β bestehen. Die neurotoxische Wirkung, die zu den Symptomen der Alzheimer Demenz führt wird ebenfalls diesem Peptid zugeschrieben, das einzeln oder in kleinen Aggregaten in den Membranen der Nervenzellen aktiv ist. In welcher Weise Amyloid-β allerdings die Nervenzellen tötet, ist noch umstritten. Es gibt Studien, die darauf hindeuten, dass die Peptide die Lipidschichten der Membranen durchdringen und Poren bilden, sodass diese durchlässig und porös und damit die Zellen geschädigt werden.
Welche Wirkung Amyloid-β auf die Zellmembranen hat, untersuchten Dr. Matthew Barrett vom Helmholtz Zentrum Berlin und seine Kollegen mit Neutronenstreuung an Lipidmembranen mit und ohne Peptid. Dabei nutzten sie das Flugzeitspektrometer TOFTOF betreut von Dr. Wiebke Lohstroh von der Technischen Universität München und zwei weitere Flugzeitspektrometer des Institut-Laue-Langevin (ILL) in Grenoble, Frankreich. Am TOFTOF lassen sich die Bewegung und die Diffusion der Lipide in der Membran auf einer Zeitskala von 1 – 100 Pikosekunden und auf Längenskalen von wenigen Nanometern untersuchen, während die Messungen an den Spektrometern am ILL langsamere Bewegungen abfragen.
Die Biophysiker beobachteten, dass nur geringe Mengen des Amyloid-β die Bewegungen der Lipide in der Membran deutlich beinflussen. Die veränderte Beweglichkeit könnte noch schädlicher für die normale Funktion der Zellmembran sein als die Porenbildung, die oft mit dem Peptid in Verbindung gebracht wird, vermuten die Autoren. Die Zelle kann dann zum Beispiel Signale nicht mehr richtig weiterleiten und stirbt ab. Die Plaques aus Amyloid-β wiederum, die in Zusammenhang mit der Alzheimer Demenz auftreten, könnten eine Art Mülleimer für das schädliche Peptid sein. Damit sie die Zellmembranen nicht zerstören, so die Theorie der Wissenschaftler, werden die vagabundierenden Amyloid-β-Peptide in den Plaques abgelagert.
Originalpublikation:
Alzheimer’s peptide amyloid-β, fragment 22-40, perturbs lipid dynamics
Barrett MA, Trapp M, Lohstroh W, Seydel T, Ollivier J, Ballauff M, Dencher NA, Hauß T.
Soft Matter. 2016 Feb 7; 12(5):1444-51,
doi: 10.1039/c5sm02026c
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:


