MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
02.08.2013
Maschinen des Lebens arbeiten auch ohne Wasser
Neutronenexperimente erklären Funktionsweise von Protein-Polymer-Hybriden.
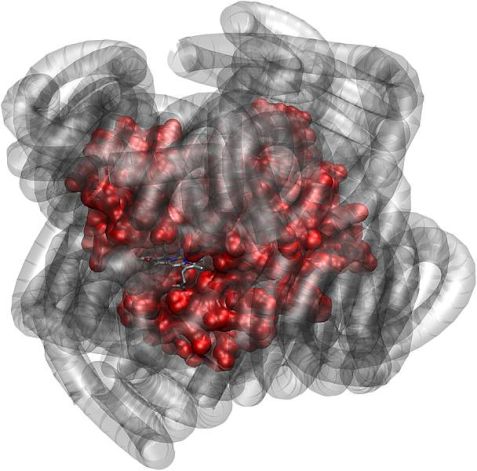
Das Eiweißmolekül Myoglobin (rot) ist biologisch aktiv, auch wenn seine natürliche Wasserhülle durch eine Polymerhülle (grau) ersetzt wird. (Quelle: J. Am. Chem. Soc., DOI, 10.1021/ja303894g)
Ohne Wasser können Proteine, die Maschinen der Zellen, ihre vielfältigen Aufgaben nicht erfüllen – dieser Grundsatz galt über Jahre. Doch 2010 entdeckten Forscher, dass Hybride aus Proteinen und Polymeren auch ohne Wasser biologisch aktiv sein können. Solche Hybride sind für industrielle Prozesse von Interesse, bei denen Wasser nicht verwendet werden kann. Warum Proteine auch ohne Wasser arbeiten, zeigt jetzt ein internationales Forscherteam mit Hilfe von Neutronenexperimenten.
Proteine sind winzige biologische Maschinen. Sie katalysieren lebenswichtige Prozesse in tierischen und pflanzlichen Zellen, geben Geweben Halt oder synthetisieren Stoffe für Medizin und Industrie. Lange ging man davon aus, dass Wasser oder andere Lösungsmittel unverzichtbar wären für die Arbeit der Moleküle. Denn Wasser vermittelt den Proteinen eine Beweglichkeit, ohne die sie nicht funktionieren. Trocknet man die Proteine aus oder friert das Wasser ein, so geht die Beweglichkeit und damit auch die Funktionsfähigkeit verloren, ganz so, wie sich ein eingefrorenes Schloss nicht mehr öffnen lässt.
Ein alternatives „Schmiermittel“ für Proteine entdeckten Forscher erstmals 2010. Sie beobachteten, dass Hybride aus dem Muskelprotein Myoglobin und Polymeren reversibel Sauerstoff binden können, ganz so wie das Myoglobin in seiner natürlichen Form.
Forscher aus Frankreich, Großbritannien, Australien und Deutschland konnten jetzt die Gründe dafür nachweisen. Neutronenexperimente an Instrumenten des Forschungszentrums Jülich an der Forschungs-Neutronenquelle Heinz Maier-Leibnitz (FRM II) in Garching bei München und an Instrumenten des Institut Laue-Langevin (ILL) im französischen Grenoble machten die Untersuchungen möglich.
Die Forscher fanden, dass sich Proteine, die von einer Polymerschicht bedeckt sind, vergleichbar bewegen können wie Proteine, die von einer Schicht Wasser bedeckt sind. Auch ist die Polymerschicht vergleichbar flexibel wie die Wasserschicht. „Das Hydratwasser von Proteinen kann also durch Polymere ausgetauscht werden, ohne dass die Proteine ihre Beweglichkeit und damit ihre Funktionsfähigkeit einbüßen“, erläutert Dr. Martin Weik vom Institut de Biologie Structurale in Grenoble. Diese Entdeckung könnte sich die Industrie zunutze machen.
Die Forscher nutzten für ihre Messungen die Fähigkeit von Neutronen aus, sehr sensitiv und zerstörungsfrei die atomaren Strukturen und Bewegungen von biologischem Material abbilden zu können. Indem sie entweder die Proteinbestandteile oder die Polymerbestandteile der Hybride einfärbten, konnten sie die Bewegungen der beiden Komponenten getrennt voneinander untersuchen. „Das geht so nur mit Neutronen“, erläutert Dr. Joachim Wuttke vom Jülicher Zentrum für Forschung mit Neutronen (JCNS) in Garching bei München.
Originalveröffentlichungen
A polymer surfactant corona dynamically replaces water in solvent-free protein liquids and ensures macromolecular flexibility and activity;
Gallat et al. ;
J. Am. Chem. Soc.
DOI, 10.1021/ja303894g
Dynamical Coupling of Intrinsically Disordered Proteins and Their Hydration Water: Comparison with Folded Soluble and Membrane Proteins; Gallat et al.;
Biophysical Journal,
Volume 103,
Issue 1,
3 July 2012,
Pages 129–136;
DOI: 10.1016/j.bpj.2012.05.027
Weitere Informationen
zur Pressemitteilung des JCNS
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:


